
周军年

纳米工程化红细胞及干细胞衍生物用于靶向治疗
报告人:周军年
所在单位:军事医学研究院
报告人简介:周军年,副研究员,研究生导师。复旦大学生物科学学士学位,军事医学科学院病理学与病理生理学博士学位,芬兰生物科学中心国家公派留学博士后。现任军事医学研究院二所青年科技委主任。主要从事干细胞与再生医学研究,尤其在先进材料助力的再生医学前沿交叉研究方面有较好创新性成果,先后承担10余项课题研究。在Advanced Materials、ACS Nano、Advanced Science、Hepatology等杂志共发表文章40余篇。授权国家发明专利5项。为中华医学会组织修复与再生分会第一、二届青年委员,担任Gene Therapy编委和Bioactive Materials、Advanced Science、Biomaterials、Int. J. Biol. Macromol.等期刊审稿人。先后获北京市科学技术奖一等奖1项(2014-5)和北京市科学技术奖自然科学二等奖1项(2023-2)。
报告摘要:
随着交叉学科的快速发展,靶向治疗已经不再局限于肿瘤治疗领域。研发新型靶向治疗策略在包括肿瘤治疗、病原体入侵以及组织损伤修复在内的重要的生命科学与健康研究领域都具有重要的研究价值。我们课题组最近在新冠病毒入侵宿主细胞和辐射联合创面损伤修复中分别开发了新型靶向治疗策略。
一、纳米工程化红细胞有效阻止新冠病毒入侵宿主细胞。
具有弗林蛋白酶(Furin)、跨膜丝氨酸蛋白酶2(TMPRSS2)、组织蛋白酶L(CTSL)和血管紧张素转换酶2(ACE2)受体结合的酶活性是冠状病毒进入宿主细胞所必需的。在病毒感染周期中精确抑制ACE2+肺细胞中的这些关键蛋白酶应该可以阻止病毒刺突(S)蛋白激活及其与宿主细胞膜的融合,从而避免病毒进入细胞。在这项研究中,我们构建了与抗hACE2抗体偶联的双药联合(TMPRSS2抑制剂Camostat和CTSL抑制剂E-64d)纳米载体(NC),并采用红细胞(RBC)搭便车技术,我们命名为“纳米工程化红细胞”(Nanoengineered Red Blood Cells),将其用于靶向肺部细胞。我们报告了双药负载纳米工程化红细胞在假病毒感染的K18-hACE2转基因小鼠中的显著治疗效果。值得注意的是,我们的模块化纳米工程红细胞(抗受体抗体+NCs+RBCs)可以通过精准靶向肺部宿主细胞的关键蛋白酶,无论病毒如何变异,均可阻止严重急性呼吸系统综合症冠状病毒2(SARS-CoV-2)的进入。我们的研究结果有望促进一系列新型安全的基于宿主细胞保护的抗病毒疗法的开发。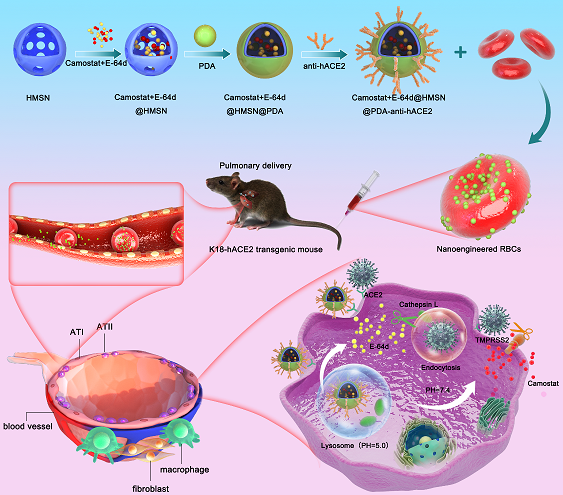
图1. 纳米工程化红细胞有效阻止新冠病毒入侵宿主细胞的示意图
我们借助于“红细胞搭便车技术”建立了纳米工程化红细胞,并以阻断新冠病毒入侵宿主细胞为目标进行构建。采用介孔硅纳米载体负载抑制新冠病毒入侵关键酶抑制剂,并偶联ACE2抗体于载体表面,获得可以精准靶向ACE2+细胞的纳米载体,将该纳米载体与红细胞共孵育,获得治疗性“赋能”红细胞。该红细胞经过静脉注射后,可首先富集于肺部,通过肺部远端毛细血管的挤压变形,红细胞释放其“搭载”的纳米载体,纳米载体特异性结合ACE2+细胞,通过内吞作用进入溶酶体后,在酸性环境下特异性降解,抑制剂释放,抑制目标蛋白酶活性,阻断病毒进入细胞。
HMSN:中空介孔二氧化硅纳米颗粒;PDA:聚多巴胺;ATⅠ:I型肺泡上皮细胞;ATⅡ:II型肺泡上皮细胞;Blood vessel:血管;Fibroblast:成纤维细胞;Macrophage:巨噬细胞;Endocytosis:胞吞作用;Lysosome:溶酶体。
Hui Yang#, Jun-Nian Zhou#,*, et al., Xue-Tao Pei*, Wen Yue*. Nanoengineered Red Blood Cells Loaded with TMPRSS2 and Cathepsin L Inhibitors Block SARS-CoV-2 Pseudovirus Entry into Lung ACE2+ Cells. Adv Mater. 2024 Apr;36(15):e2310306. (IF 28.9)(#第一作者,*通讯作者)
Video Abstract Link:https://doi.org/10.1002/adma.202310306
二、载有富含干细胞线粒体的微囊泡的水凝胶微针贴片促进慢性伤口愈合
辐射暴露导致的线粒体功能障碍在慢性伤口的持续性氧化应激中起着关键作用。越来越多的证据表明,间充质干细胞的治疗效果可能主要源自其旁分泌的细胞外囊泡(Extracellular Vesicles,EVs),EVs正成为有吸引力的无细胞和更安全的治疗来源。在此,我们假设用二甲双胍处理人脂肪来源干细胞(Adipose-derived Stem Cells, ADSCs)可促进线粒体的生物生成,从而增加含有线粒体的EVs("Met-EVs")的分泌。为了充分验证Met-EVs的治疗效果,我们在体外和体内建立了X射线诱导的线粒体功能障碍模型。制备的Met-EVs可通过转移活性线粒体改善辐照细胞的线粒体功能障碍,包括以剂量依赖的方式挽救线粒体膜电位(ΔΨm)、提高三磷酸腺苷(ATP)水平和减少活性氧(ROS)生成。此外,我们构建的负载Met-EVs的脱细胞脂肪基质(Decellularized Adipose Matrix,DAM)结合甲基丙烯化透明质酸(Hyaluronic Acid Methacrylic Acid,HAMA)水凝胶微针贴片(Microneedle Patch,MNP)能够将Met-EVs及其所含线粒体装载并逐渐释放到辐照伤口组织中,从而改善线粒体功能障碍。同时体内模型中发现Met-EVs促进巨噬细胞向具有抗炎和再生功能的M2亚型极化,从而促进小鼠放射性损伤皮肤的愈合。综上所述,Met-EVs@DAM/HAMA-MNP的疗效已在本研究中得到证实,并在临床上对慢性伤口具有巨大的治疗潜力。
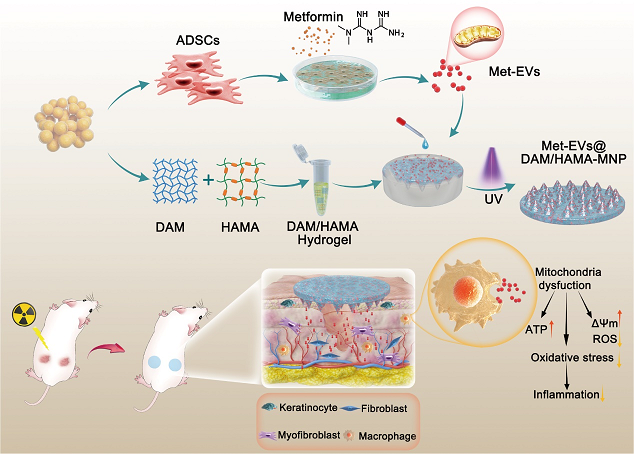
图2. 载有富含干细胞线粒体的微囊泡的水凝胶微针贴片促进慢性伤口愈合示意图
Met-EVs@DAM/HAMA-MNPs能持续有效地将含有活性线粒体的EVs导入受辐照创面组织,通过增加ATP生成,降低ROS含量和氧化应激压力,促进巨噬细胞从促炎性M1亚型向具有抗炎和创伤愈合功能的M2亚型极化,改善线粒体功能障碍。
ADSCs:人脂肪来源干细胞;DAM:脱细胞脂肪基质;HAMA:甲基丙烯化透明质酸;Met-EVs:二甲双胍处理ADSCs来源的富含线粒体的细胞外囊泡;UV:紫外线;MNP:微针贴片;ΔΨm:线粒体膜电位;ATP:三磷酸腺苷;ROS:活性氧;Keratinocyte:角质细胞;Fibroblast:成纤维细胞;Myofibroblast:激活的成纤维细胞;Macrophage:巨噬细胞。
Wen-De Yao#, Jun-Nian Zhou#,*, et al., Yan Han*, Wen Yue*. Hydrogel Microneedle Patches Loaded with Stem Cell Mitochondria-Enriched Microvesicles Boost the Chronic Wound Healing. ACS Nano. (IF:16.2)(#第一作者,*通讯作者)
文章链接:https://pubs.acs.org/doi/10.1021/acsnano.4c06921