
仝令君

工程化乳源外泌体递送miR-30d治疗肥厚性心力衰竭
报告人:仝令君
所在单位:山东第一医科大学
报告人简介:仝令君,副教授,“泰山学者”青年专家,科创中心徐涛院士团队骨干,硕士生导师。博士毕业于中国海洋大学。曾在新加坡国立大学(NUS)杨潞龄医学院,纳米医学中心A*STAR进行科研训练。主要研究方向为:(1)心血管疾病新型生物标志物的筛选;(2)基于食源外泌体作为口服递送载体的精准靶向治疗;(3)外泌体大规模生产技术的开发与应用。主持国家自然基金、山东省自然科学基金共3项,山东省泰山学者青年项目1项。近5年,以第一作者/通讯作者分别在Science Advances(高被引,IF=13.6),Journal of Extracellular Vesicles(IF=15.5),Biomaterials(IF=12.9),Theranostics(高被引,封面文章,IF=12.4),Advanced Drug Delivery Reviews(高被引,IF=17.6),Chemical Engineering Journal(IF=13.2)等国际知名期刊发表SCI数十篇,并授权国际PCT发明专利1项(排名第二位)。荣获Wiley中国科学创新杰出贡献奖,基础临床优秀成果奖(省级)等。主要学术兼职:美国细胞外囊泡官方会刊《Extracellular Vesicle》青年编委;《Food Science of Animal Products》青年编委;国际液体活检官方会刊《Extracellular Vesicles and Circulating Nucleic Acids》青年编委;国际细胞外囊泡协会(ISEV)Milk Task Force成员;山东省健康管理协会微生态医学专业委员会常务委员;中国研究型医院学会细胞外囊泡研究与应用委员会青年委员。
报告摘要:
心力衰竭是影响全球超过 6400 万人的流行性疾病,其主要特征为活动后明显呼吸困难,也是肥厚型心肌病(HCM)广泛临床谱系中的常见并发症。目前尚无有效治疗手段。越来越多的证据表明,microRNA(miRNA)参与心肌肥厚的进展,并有望成为 HCM 的治疗靶点。尤其是,人类循环中的miR30d 已被证实与多种心血管疾病(CVD)的发病进展相关,包括心肌肥厚、心脏重构及心力衰竭。然而,将 miR30d 有效递送至心脏仍面临巨大挑战。
方法:在本研究中,我们将心肌缺血靶向肽(IMTP)与乳源细胞外囊泡(mEVs)偶联,并负载miR30d(一种用于治疗心肌肥厚的 miRNA),构建了一种新型靶向递送系统(miR30d-mEVsIMTP)。为验证工程化 mEVs 在病理状态下心肌细胞的靶向能力,我们检测了 Cy5 标记的 mEVs 与 Cy5 标记的 mEVsIMTP 在低氧预处理的大鼠 H9C2 细胞和人源 AC16 细胞中的摄取情况。此外,我们在异丙肾上腺素(ISO)、血管紧张素 II(AngII)和主动脉缩窄术(TAC)诱导的小鼠心肌肥厚模型中评估了 miR30d-mEVsIMTP 的治疗效果。
结果:结果显示,miR30d-mEVsIMTP 可在体外通过内溶酶体途径高效进入低氧处理的 H9C2 细胞和 AC16 细胞。在 ISO 诱导的心肌肥厚小鼠模型中,静脉注射后 miR30d-mEVsIMTP 在心脏组织中的累积量显著高于 miR30d-mEVs。进一步研究发现,miR30d-mEVsIMTP 能够在三种小鼠肥厚性心力衰竭模型中缓解心肌肥厚并改善心功能。机制上,我们提出 GRK5 是 miR30d 在心肌肥厚中的作用靶点。总体而言,我们的研究结果表明,结合 IMTP 的 mEVs 可实现 miR30d 在病理性心脏中的高效递送,从而通过靶向 GRK5 改善心肌肥厚和功能障碍。
讨论:总之,我们的研究表明,静脉注射 miR30d-mEVsIMTP 能有效缓解心力衰竭中的心肌肥厚、炎症和纤维化,其机制在于将 miR30d 靶向递送至病理性心脏,并通过 GRK5 介导的趋化因子信号通路发挥心脏保护作用。本研究建立了一种稳健的基于 IMTP-mEVs 的递送平台,在心血管疾病基因治疗中具有广阔的应用前景。
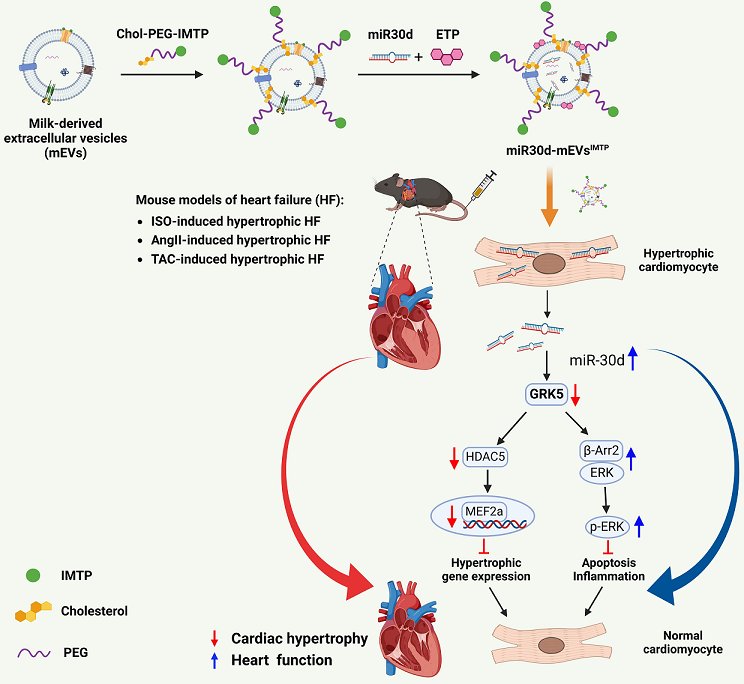
图 1. 示意图展示了工程化 miR30d-mEVsIMTP的制备过程及其缓解肥厚性心力衰竭(HF)的潜在作用机制